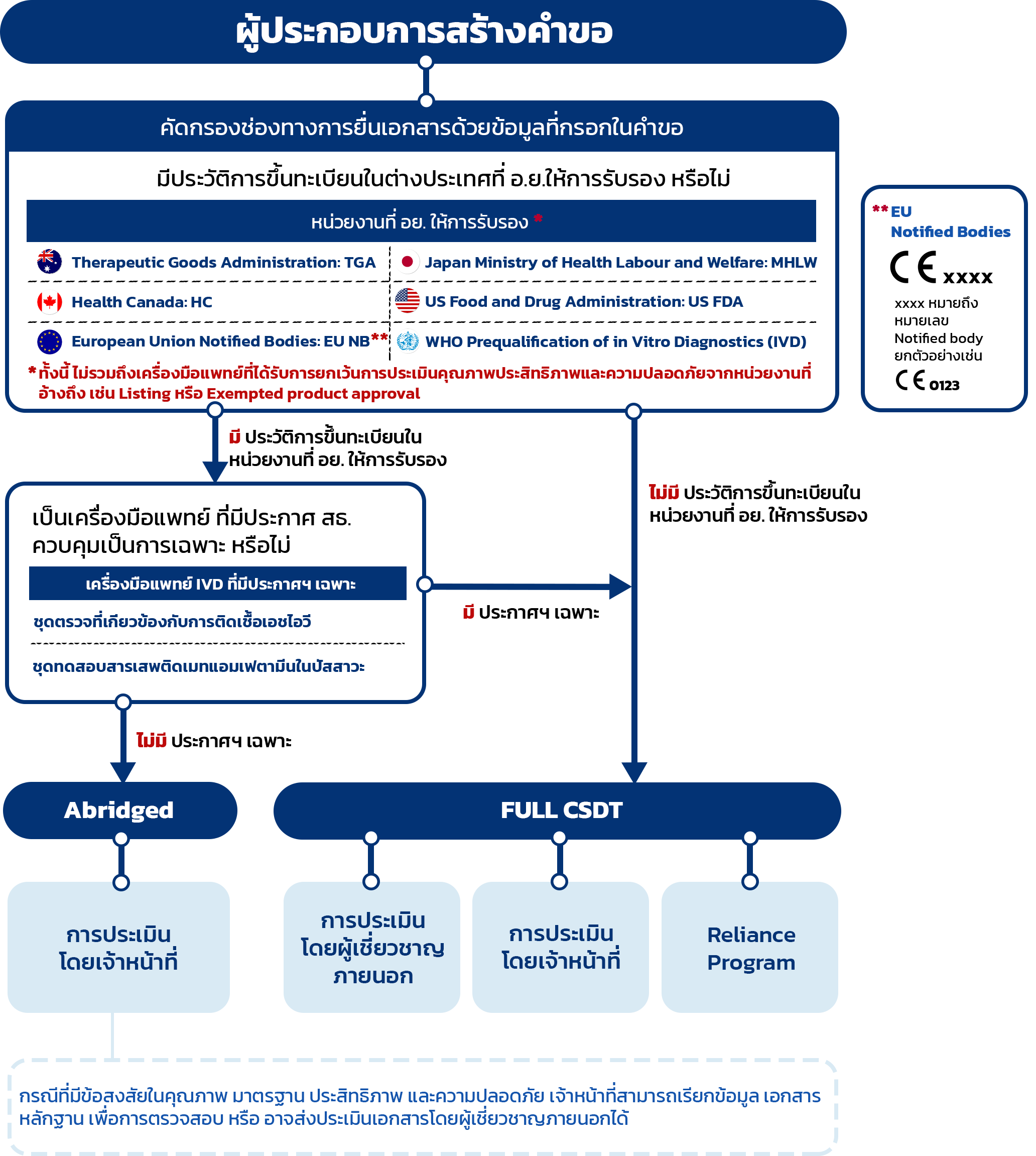
เครื่องมือแพทย์สำหรับการวินิจฉัยภายนอกร่างกาย (IVD)
เครื่องมือแพทย์สำหรับการวินิจฉัยภายนอกร่างกาย (IVD)
สรุปรายการเอกสารที่ต้องเตรียมเพื่อยื่นคำขอขึ้นทะเบียนเครื่องมือแพทย์ IVD
ในระบบ e-Submission สำหรับความเสี่ยงประเภทที่ 2 - 4
ลำดับ | เอกสารที่ต้องเตรียม | รูปแบบการยื่นคำขอ | |
Full CSDT | Abridged | ||
1 | ฉลากเครื่องมือแพทย์ (Device Labeling) |
|
|
2 | เอกสารกำกับเครื่องมือแพทย์ |
|
|
3 | บทสรุปเกี่ยวกับเครื่องมือแพทย์ (Executive summary) โดยต้องมีรายละเอียดดังนี้ 1) อธิบายสรุปภาพรวมของเครื่องมือแพทย์ 2) ตารางแสดงประวัติการได้รับอนุมัติการขึ้นทะเบียนหรืออนุญาตให้วางจำหน่ายในท้องตลาด และประวัติการจำหน่ายในประเทศต่างๆ 3) ตารางแสดงรายละเอียดของการถูกเพิกถอน (ถ้ามี) 4) ตารางแสดงสถานภาพของคำขอขึ้นทะเบียนหรืออนุญาตเพื่อวางจำหน่ายผลิตภัณฑ์ในตลาดที่ยังค้างอยู่หรืออยู่ในระหว่างดำเนินการ (ถ้ามี) 5) ตารางแสดงรายงานเหตุการณ์อันไม่พึงประสงค์จากการใช้เครื่องมือแพทย์ให้แนบเอกสารระบุรายละเอียดของ AE 6) ตารางแสดงรายงาน field safety corrective action (FSCAs) ให้แนบเอกสารระบุรายละเอียดของรายงาน FSCAs |
|
|
4 | รายละเอียดเครื่องมือแพทย์ (Device Description) โดยต้องมีรายละเอียดดังนี้ 1) ลักษณะทั่วไป และหลักการทำงาน (Device Description and Features) 2) วัตถุประสงค์การใช้ (Intended Use) 3) คำแนะนำการใช้ (Instructions of Use) 4) การเก็บรักษา 5) อายุการใช้งาน 6) ข้อจำกัด (Limitations) / ข้อห้ามใช้ 7) คำเตือน (Warnings) 8) ข้อควรระวัง (Precautions) 9) รายละเอียดของวัสดุที่ใช้ผลิตหรือเป็นส่วนประกอบของเครื่องมือแพทย์ (Materials) "คลิกเพื่อศึกษารายละเอียดเพิ่มเติม" 10) ข้อกำหนดเฉพาะอื่น ๆ ที่เกี่ยวข้อง (Product Specifications) 11) ข้อมูลรายละเอียดอื่น ๆ (Other Descriptive Information) |
|
|
5 | หลักการสำคัญที่เกี่ยวกับความปลอดภัยและสมรรถนะการทำงานเครื่องมือแพทย์และวิธีการแสดงถึงความสอดคล้อง (Essential principles) |
|
|
6 | เอกสารสรุปการทวนสอบและการตรวจสอบความถูกต้องของการออกแบบ (Summary Verification & Validation) |
| - |
7 | เอกสารแสดงการวิเคราะห์ความเสี่ยง (Risk Analysis) |
| - |
8 | เอกสารแสดงชื่อและที่ตั้งของสถานที่ผลิตเครื่องมือแพทย์ และข้อมูลการผลิตเครื่องมือแพทย์หรือรายละเอียดเจ้าของผลิตภัณฑ์ (Manufacturer Information) |
|
|
9 | เอกสารแสดงวิธีการทำลาย การทำให้สิ้นสภาพ หรือการขจัดของเสียที่เกิดขึ้นภายหลังการใช้ (ถ้ามี) |
| - |
10 | หนังสือรับรองระบบคุณภาพ เช่น ISO/GMP กรณี ISO13485 ต้องเป็นไปตามข้อกำหนด ดังนี้ 1. ISO13485 ต้องได้รับการรับรองครอบคลุม Scope ครบถ้วนตั้งแต่ Design & Development, Manufacturing (Production) และ Distribution เครื่องมือแพทย์ที่ต้องการขึ้นทะเบียน และสอดคล้องกับสถานที่เกิดกิจกรรมขึ้นจริงตาม Manufacturing Process 2. Certified body ผู้ให้การรับรอง ISO13485 ต้องได้รับการ Accredit โดย Accreditation body |
|
|
11 | หนังสือรับรองวัตถุประสงค์การใช้ ข้อบ่งใช้ การบรรจุ หนังสือรับรองฉลากและวิธีการใช้งาน ของผู้ผลิตหรือเจ้าของผลิตภัณฑ์ (Declaration Letter) | - |
|
12 | หนังสือรับรองความสอดคล้องของผลิตภัณฑ์จากผู้ผลิตหรือเจ้าของผลิตภัณฑ์ (Declaration of Conformity) |
|
|
13 | หนังสือรับรองแสดงประวัติการจำหน่ายเครื่องมือแพทย์ของผู้ผลิตหรือเจ้าของผลิตภัณฑ์ (Market History Declaration) | - |
|
14 | หนังสือรับรองแสดงความปลอดภัยของผู้ผลิตหรือเจ้าของผลิตภัณฑ์ (Safety Declaration) | - |
|
15 | หลักฐานการอนุญาตจากหน่วยงานที่มีหน้าที่และอำนาจกำกับดูแลคมพ.ในต่างประเทศที่ อย.รับรอง (Product License) | - |
|
16 | หนังสือมอบอำนาจจากเจ้าของผลิตภัณฑ์ให้เป็นตัวแทน ในกรณียื่นนำเข้าเครื่องมือแพทย์ (Letter of authorization) | กรณีนำเข้า | กรณีนำเข้า |
17 | เอกสารชี้แจงรายการเครื่องมือแพทย์ที่ได้รับการจดทะเบียนแบบรวมกลุ่มเครื่องมือแพทย์ (ถ้ามี) | (ถ้ามี) | (ถ้ามี) |
 หมายถึง ต้องแนบ
หมายถึง ต้องแนบ